Versuch: Gase wiegen und Bestimmung der Gas-Dichte
Das Füllen mit Gas:
Für H2-Gas ist das Wiegen sehr einfach. Weil das Gas so viel leichter als Luft ist kann man es einfach ähnlich wie Wasser in eine Flasche laufen lassen, nur eben auf den Kopf gestellt! Halte die Flasche mit der Öffnung nach unten, schiebe den H2-Gas-Schlauch von unten in die Ausgieß-Öffnung so lange, bis sie sicher vollständig mit dem nach oben ausströmenden Gas gefüllt ist. Um ganz sicher zu sein, dass die Flasche auch ganz mit dem Gas gefüllt ist, lass etwa 1,5 bis 2-mal so viel Gas in die Flasche strömen. Bei einem Inhalator, der 300 ml Gas pro Minute produziert, füllst du dann eben mindestens 4 Minuten lang je Liter Flaschenvolumen. Länger schadet auch nicht. Dann den Schlauch ganz langsam aus der Flasche ziehen und den Deckel aufschrauben, ohne die Flasche zu drehen.
Der Theorie nach wiegt 1 Liter H2-Gas 0,083 g und Luft 1,293 g, die Differenz wäre dann 1,2 g/l jeweils bei Raumtemperatur.
In der Praxis mit dieser Handhabung sollte der Unterschied zwischen Luft und H2-Gas in der Flasche wenigstens noch 1 Gramm je Liter Flaschenvolumen betragen.
Schwieriger ist das Füllen einer Flasche mit Gas, welches ähnlich schwer wie Luft ist, z.B. Sauerstoff (O2), oder mit einem Mischgas (schwer und leicht) wie Knallgas, weil es der Flasche entweichen, weil die schwereren Moleküle nach unten aus der Flaschen sinken. Hier kann man die Methode des Unter-Wasser-Füllens anwenden, welche hier beschrieben ist. Hierbei muss die Flasche auch unter Wasser zugeschraubt werden. Nach dem Füllen unter Wasser die verschlossene Flasche von außen gut abtrocknen.
Das Wiegen der Differenz zwischen Gas und Luft kann in beiden Fällen gleich erfolgen:
- Die Flasche verschlossen, mit der Öffnung nach oben auf die Waage stellen
- Die Waage auf null tarieren (da gibt es meistens eine Taste dafür)
- jetzt den Deckel vorsichtig abschrauben und mit auf die Waage legen, dabei darauf achten, dass auch Wassertropfen, die ev. im Deckel sind, dort bleiben oder aus dem Deckel mit auf die Waage fallen
- Jetzt oben vorsichtig in die Flasche blasen (ohne Speichel oder mit einem Föhn) damit sich das Gas in der Flasche gegen Luft ausgetauscht wird.
Wenn sich die Gewichtsanzeige durch weiteres Blasen nicht mehr ändert, ist alles Gas durch Luft ersetzt - Die Waage zeigt jetzt das Gasgewicht an. Ist der Anzeigewert negativ war das Gas leichter als Luft, ist der Wert positiv, so war es schwerer.
Meine Wiegewerte waren für ein 2 Liter fassendes TetraPak:
Wasserstoff (H2) - 2,1 g
Knallgas ( 2 x H2 und 1 x O2) - 1,4 g
Sauerstoff (O2) + 0,2
H2-Gasausgleich durch eine geschlossene PET-Flasche
Jedes Gas ist bestrebt, sich gleichmäßig in dem ihm zur Verfügung stehenden Raum zu verteilen, in der Luft genauso wie im Wasser.
Ist die H2-Konzentration im Wasser höher als in der Luft darüber, so diffundiert H2-Gas aus dem Wasser so lange aus, bis in der Umgebungsluft eine vergleichbare Konzentration herrscht.
Da aber das super-leichte H2-Gas aus unserer Luft vollständig in die obersten Luftschichten entweicht, entweicht auch alles H2-Gas aus dem Wasser, wenn nicht die Luft über dem Wasser in den gleichen gasdichten Behälter mit eingeschlossen ist, sodass sich dort das ausgasende H2 "staut". Auf diesem Prinzip basiert die Autoventil-Methode mit den gasdichten Glasflaschen. Hier ist die H2-Gas-Konzentration über dem eingefüllten Wasser größer und das H2-Gas diffundiert in das Wasser bis ein Konzentrationsgleichgewicht erreicht wurde. Steht die mit dem Wasser eingeschlossene H2-Gas-Atmosphäre noch dazu unter Überdruck, wird das Wasser mit H2-Gas "übersättigt".
Dass eine PET-Mehrweg-Flasche (Mineralbrunnenflasche) zwar dicht für die größeren Moleküle in der Luft ist (O2, CO2), aber nicht dicht für die winzig-kleinen H2-Moleküle zeigt dieses faszinierende Experiment:


Ein kleiner Wasserstoff Inhalator füllt die Flasche und H2-Gasblasen blubbern in die Flasche
Fülle eine leere PET-Sprudelflasche vollständig mit Wasserstoff, ohne dass andere Gase mit in der Flasche sind.
Dazu fülle die Flasche zunächst komplett mit Leitungswasser. Halte dann die Öffnung mit dem Daumen oben zu und stelle die Flasche kopfüber in eine wassergefüllte Schüssel. Das Wasser bleibt jetzt in der Flasche, auch wenn sie wieder geöffnet ist. Stecke den Auslass-Schlauch von einem H2-Inhalator von unten durch das Wasser in den Flaschenhals. Warte, bis das austretende H2-Gas alles Wasser in der Flasche ersetzt hat und unten neben der Flasche heraus blubbert. Dann hebe die Flasche so wie sie ist, kopfüber aus dem Wasser und schraube sofort den Flaschendeckel dicht auf.

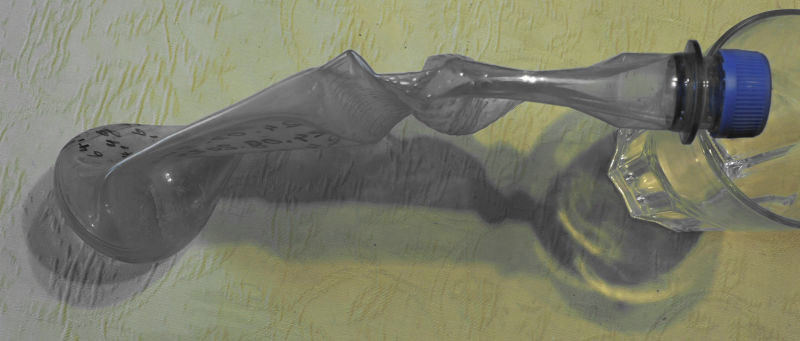
PET-Flasche nach 1 Monat und nach 68 Tagen
Jetzt beobachte, was mit der relativ dicken und steifen PET-Flasche über die nächsten Monate geschieht.
Die Flasche schrumpelt mit der Zeit immer mehr zusammen und die PET-Flasche scheint von geisterhaften Kräften völlig zerquetscht zu werden!
Hier noch deutlicher zu sehen eine vollständig mit H2-Gas gefüllte Mineralbrunnen PET-Flasche nach 6 und 10 Monaten Lagerung. Das Volumen nimmt bis zum "Geht-nicht-mehr" ab und das Gesamtgewicht nimmt um ca. 0,6 Gramm zu, weil der entwichene Wasserstoff ja leichter als die Umgebungsluft ist.
PET-Flasche vollständig mit H2-Gas gefüllt (waagrecht) und nach 6 Monaten Lagerung im Zimmer
Dieselbe PET-Flasche nach 10 Monaten Lagerung im Zimmer
Tatsächlich entsteht in der Flasche ein zunehmendes Vakuum, weil die kleinen H2-Moleküle heraus diffundieren können, aber Luft-Moleküle können nicht herein diffundieren, weil sie zu groß sind. Die Flasche ist also luftdicht, aber nicht ganz H2-dicht und der Überdruck unserer Atmosphäre von 1 bar (entsprechend ca. 10 m Tauchtiefe) zerquetsch die zunehmend tatsächlich Gas-leere Flasche. Würde unsere normale Umgebungsluft auch H2-Gas enthalten, so würde der Vorgang des "Schrumpelns" stoppen, wenn die H2-Konzentration innen mit derjenigen in der Außenluft ins Gleichgewicht kommt.
Mit einer dünnen Einweg-PET-Flasche geht der Vorgang deutlich schneller, ist aber nicht so eindrucksvoll, weil man die ja auch mit Muskelkraft leicht zerquetschen kann.
Erstaunlicherweise ändert sich dieses Verhalten aber, wenn die Flasche nicht nur mit H2-Gas gefüllt ist, sondern auch noch (viel) Wasser enthält und das H2-Gas zusätzlich unter Druck steht. Das ist der Fall, wenn ich meine nach der Autoventil-Methode geladenen Flaschen mit H2-Wasser und reiner H2-Gas-Atmosphäre lagere. Ich erkläre mir den Grund dafür so, dass in der zusätzlich mit Wasser gefüllten Flasche ständig eine Gas-Feuchte von 100 % Sättigung herrscht und diese Feuchte die Feinst-Porosität des PET-Werkstoffes verschließt. Wer mir dieses Phänomen erklären kann, bitte melden (ich bin weder Chemiker noch Physiker)