Wissenswertes über Wasserstoff im Wasser
Wenn es um H2-Wasser geht, interessiert es natürlich zu aller erst: wie hoch ist die natürliche Konzentration von gelöstem Wasserstoff-Gas (also von H2-Molekülen) im Trinkwasser, und wie kann die Konzentration erhöht werden?
Oberflächenwasser, das übliche Trinkwasser aus der Wasserleitung und auch viele Mineralwässer haben alle einen ähnlichen hohen Gehalt an H2 wie die Atemluft im Freien, und der ist äußerst gering (nämlich 0,0000036 Gew.-% oder 0,036 ppm oder 36 ppb). Das liegt daran, dass sich das Verhältnis unterschiedlicher gelöster Gase im Wasser dem Verhältnis in der Luft über dem Wasser angleichen (siehe Gasgleichgewicht).
Quellwasser direkt an der Quelle kann deutlich mehr H2-Gas enthalten, welches dann aber recht schnell in die Luft entweicht, wenn es zutage tritt und nicht gleich in dichte Glasflaschen abgefüllt wird. Heilwässer aus größerer Tiefe können sich so durch einen höheren H2-Gehalt auszeichnen, falls im Tiefengestein freies H2 vorhanden ist.
Die Löslichkeit von H2-Gas im Wasser wird so ermittelt, dass destilliertes Wasser zunächst vollständig "entgast" wird und dann einer Atmosphäre ausgesetzt wird, die nur aus reinem H2-Gas besteht. Dann wandert mit der Zeit selbstständig die maximale Menge H2 ins Wasser. Das maximal erreichte Gehalt des im Wasser so gelösten Wasserstoffs wird als Löslichkeit oder Sättigungswert bezeichnet. Das zuvor gasfreie, destillierte Wasser ist also dann mit H2 gesättigt, weil von sich aus nicht noch mehr H2 aus der reinen H2-Atmosphäre über dem Wasser in dieses Wasser wandert.
Diese natürliche H2-Sättigung hängt von der Wassertemperatur ab, und noch viel mehr von dem Druck in der Gasatmosphäre über dem Wasser!
Dieser H2-Gasdruck über dem Wasser ist natürlich auch immer gleich dem Wasserdruck.
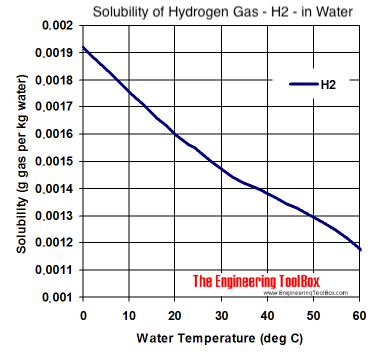
Dieses Diagramm zeigt die Sättigung bei normalem Luftdruck und unterschiedlicher Temperatur:
Entnommen aus: https://www.engineeringtoolbox.com/gases-solubility-water-d_1148.html
Bei Raumtemperatur und ohne Überdruck lösen sich also maximal 0,0016 g H2-Gas in 1 kg Wasser, also ca. 1,6 Milligram je Liter Wasser.
Das ist dann, was auch als eine Konzentration nach Gewichtsanteilen von 1600 ppb (ppb ist die Einheit "parts per billion", auf deusch: 1 zu einer Milliarde!) oder von 1,6 ppm (ppm ist die entsprechende Abkürzung von "parts per million"). Das Gewicht des gelösten Wasserstoffs (in ohne Überdruck gesättigtem H2-Wasser bei Raumtemperatur) beträgt also weniger als 2 Millionstel des Wassergewichts. Ein sehr kleiner Anteil. Aber Wasserstoff ist eben auch so leicht: 18-mal leichter als Sauerstoff.
Die Angaben in ppm (je Million) oder ppb (je Milliarde) sind so zu verstehen wie Promille (je Tausend) oder Prozent (je 100). Sie bezeichnen also einen Anteil oder ein Gehalt, aber sie sagen nichts darüber aus, um was für einen Anteil es sich handelt.
1 mg (12,12 ml) H2-Gas in einem Liter Wasser entsprechen 1000 ppb = 1 ppm = 0,001 ‰ = 0,0001 %
Das ist verwirrend und kann zu Missverständnissen führen. So ist der Gewichtsanteil von H2-Gas an der Luft 0,036 ppm, der Volumenanteil an Luft aber 0,55 ppm! Alle Angaben auf diesen Seiten sind in ppm bezogen auf das Gewicht angegeben
Aus dem Diagramm lässt sich ablesen, dass es ohne einen Überdruck nur möglich ist, je nach Temperatur, so zwischen 1,5 und 1,7 ppm H2-Gas-Gewichtsanteil ins Wasser zu bekommen, und das auch nur bei idealen Bedingungen (destilliertes Wasser ohne gelöste Fremdgase). Für die praktische Anwendung mit Leitungswasser bei Raumtemperatur sind 1,4 ppm auch schon ein guter Wert. Bei Geräten, die sowohl O2-Gas als auch H2-Gas an das Wasser abgeben (sogenannte "Double-Bubbler") kann sich daher z.B. nur etwas weniger H2-Gas im Wasser lösen, weil das gelöste O2-Gas gewissermaßen etwas "Platz wegnimmt".
Was aber noch ganz klar aus dem Diagramm hervorgeht: Wird bei Raumtemperatur H2-gesättigtes Wasser erhitzt, so entweicht gelöstes H2-Gas aus dem Wasser, da die Sättigungskonzentration mit steigender Temperatur sinkt, und aus kochendem Wasser entweichen alle gelösten Gase.
Die maximal mögliche H2-Konzentration steigt linear mit dem Druck p im Wasser: C [ppm] = (p+1) [bar] x 1,572
Arbeitet eine Booster-Flasche zur Herstellung von H2-Wasser also ohne Überdruck (p), erreicht das Wasser maximal 1,57 ppm bei Raumtemperatur, aber das ist ein theoretischer Wert der in der üblichen Anwendungspraxis nicht erreicht werden kann, außer man verwendet mehrfach destilliertes Wasser dem unter Vakuum zuvor alle gelösten Gase entzogen wurden und setzt dieses Wasser einer 100 % reinen H2-Atmosphäre aus.
![]() Hier sind die Zusammenhänge noch detaillierter erklärt. Die Aussage als Endergebnis, "dass alle Produkte, die 1600 ppb oder mehr unter Wasserstoffwasser oder Wasserstoffwassermaschinen zum Trinken einführen, falsche Produkte sind", ist aber leider eine werbewirksame Irreführung. Richtig wäre diese Formulierung: "dass alle Produkte, die ohne Überdruck arbeiten (so wie das beworbene Produkt), und von sich behaupten, mehr als die 1570 ppb ... einzuführen, ein falsches Versprechen machen." (
Hier sind die Zusammenhänge noch detaillierter erklärt. Die Aussage als Endergebnis, "dass alle Produkte, die 1600 ppb oder mehr unter Wasserstoffwasser oder Wasserstoffwassermaschinen zum Trinken einführen, falsche Produkte sind", ist aber leider eine werbewirksame Irreführung. Richtig wäre diese Formulierung: "dass alle Produkte, die ohne Überdruck arbeiten (so wie das beworbene Produkt), und von sich behaupten, mehr als die 1570 ppb ... einzuführen, ein falsches Versprechen machen." (![]() Hier ein solches falsches Versprechen, gemessen werden hier H2-Gasbläschen und nicht der gelöste Wasserstoff im Wasser)
Hier ein solches falsches Versprechen, gemessen werden hier H2-Gasbläschen und nicht der gelöste Wasserstoff im Wasser)
Erreicht ein Gerät einen Innendruck von 3 bar Überdruck, dann kann der H2-Gehalt im "übersättigtem" Wasser unmittelbar nach Ablassen des Überdrucks theoretisch maximal 6,29 ppm. Aus den oben genannten Gründen liegen die praktisch realisierbaren H2-Werte aber immer deutlich darunter. Behauptet also ein Verkäufer sein Gerät produziere H2-Wasser mit einem H2-Gehalt von mehr als 6 ppm aber der Druck im Gerät erreicht keine 4 bar Überdruck im Wasser, so ist diese Angabe rein physikalisch schon unmöglich. Realistisch erreichbar sind eher Werte von 4 bis 4,5 ppm.
Der Wasserdruck der Trinkwasserversorgung liegt je nach Ort und Höhenlage so zwischen 2 und 4 bar. Aus praktischen und sicherheitstechnischen Gründen sollten meiner Ansicht nach portable Geräte nicht über 4 bar, und fest installierte Geräte nicht über 6 bar Arbeitsdruck erzeugen.
Ein übersättigtes H2-Wasser liegt dann vor, wenn das H2-Wasser bei höherem Druck hergestellt wurde, und dann der Druck wieder auf den Normaldruck gesenkt wurde (z.B. durch Öffnen der Flasche zum Trinken). Hier genügen Erschütterungen (schütteln), ein zu schnelles Öffnen der Flasche unter Druck, oder Rühren, dass das ein Großteil des gelösten H2-Gases wieder als feine oder sehr feine Bläschen (Gas-Nebel) ausfällt. Ähnlich wie bei einem Sprudel im Glas nach dem Ausschenken, hier wurde das Wasser mit CO2-Gas (Kohlensäure) übersättigt.
Quellenangaben:
![]() https://molecularhydrogeninstitute.org/concentration-and-solubility-of-h2 (englisch)
https://molecularhydrogeninstitute.org/concentration-and-solubility-of-h2 (englisch)
Eigenschaften von H2-Gas
Auf dieser Seite sind die physikalisch-chemischen Eigenschaften von Wasserstoff-Gas zusammengestellt:
![]() Thermo-physikalische Eigenschaften (englisch)
Thermo-physikalische Eigenschaften (englisch)
![]() Zusammensetzung der Umgebungsluft (englisch)
Zusammensetzung der Umgebungsluft (englisch)
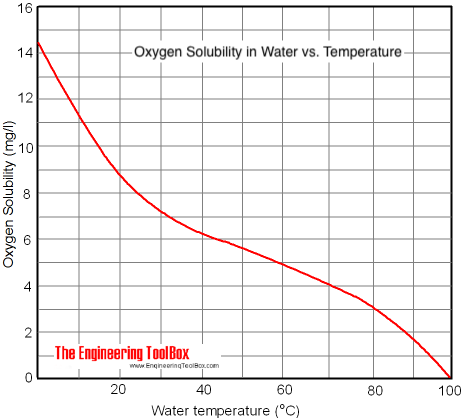
Für gelösten Sauerstoff gilt ein ähnlicher Zusammenhang, wie das folgende Diagramm zeigt. In kaltem Wasser löst sich viel mehr Sauerstoff. Darum können Fische Atemnot bekommen, wenn sich ihr Wasser ungewöhnlich stark erwärmt. In größerer Wassertiefe (Druck) und kälterem Wasser kann sich mehr Sauerstoff lösen und zur Atmung zur Verfügung stehen. Bei Raumtemperatur lösen sich demnach ca. 8,5 ppm Sauerstoff in offen stehendem Wasser.
![]() https://www.engineeringtoolbox.com/docs/documents/639/oxygen-solubility-water-2.png
https://www.engineeringtoolbox.com/docs/documents/639/oxygen-solubility-water-2.png